パイ拡張pai-expansion
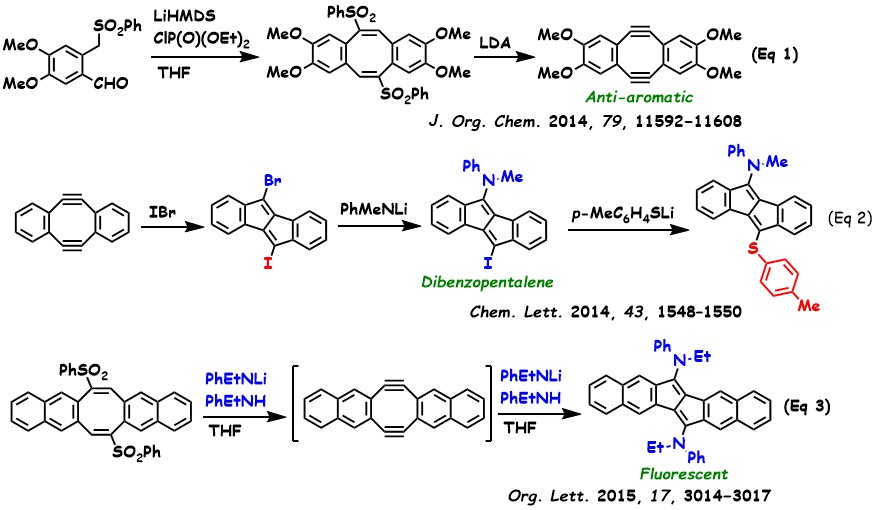
我々はホルミルスルホンを出発原料として、環化二量化および続くスルフィン酸の脱離をワンポットで行い、Sondheimer-Wong Diyne を合成した(式1)。Sondheimer-Wong Diyne は、16π電子系を有する反芳香族化合物である。興味深いことに、メトキシ基で四置換したペンタレンは大気中で安定した粉末として存在し、サンプル瓶に半年間保管しても分解は確認されなかった。
Sondheimer-Wong Diyne はさまざまな求電子剤と反応することがわかった(式2)。一臭化ヨウ素との反応では、ブロモ基とヨード基で置換されたジベンゾペンタレンが得られた。このジハロ置換ジベンゾペンタレンは、求核剤との反応を通じてさまざまな置換体へ誘導可能である。この置換反応は、芳香族性を有する10π電子系のインデニルアニオン中間体を経由する「付加―脱離」メカニズムによって進行していると推察される。
難溶性のジナフト型 Sondheimer-Wong Diyne を反応系中で生成させた後、(PhEtNLi/PhEtNH) と続けて反応させることで、アミノ基で二置換されたジナフトペンタレンを得た(式3)。興味深いことに、この生成物は反芳香族化合物であるにもかかわらず、紫外線照射下で蛍光発光を示した。
典型元素化学Typical Element Chemistry
我々は、有機硫黄や有機リンが示す特異な反応性を活用し、さまざまな有用化合物の合成に取り組んできた。
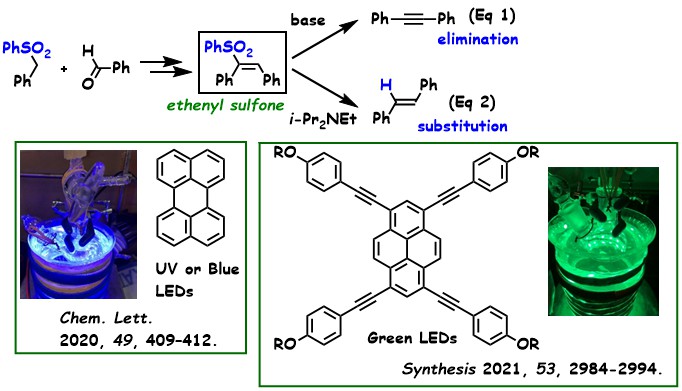
【有機硫黄を用いた反応】 ベンジルスルホンとアルデヒドの反応により調製したエテニルスルホンを塩基で処理すると、スルフィン酸が脱離し、対応するアセチレンが得られる(式1)。一方で、エテニルスルホンを光レドックス触媒および犠牲剤の存在下で可視光に曝すと、スルホニル基の置換反応が進行し、対応するオレフィンが得られる(式2)。この光レドックス反応は、従来の脱スルホニル化反応(Julia反応)とは異なり、環境負荷の大きなアマルガムを使用せずに実現可能であり、「光触媒Julia反応」として捉えることができる。
光触媒としてペリレンを用いた場合、紫外光や青色LEDが有効であり、π拡張ピレン光触媒には、緑色LEDが適していることがわかった。
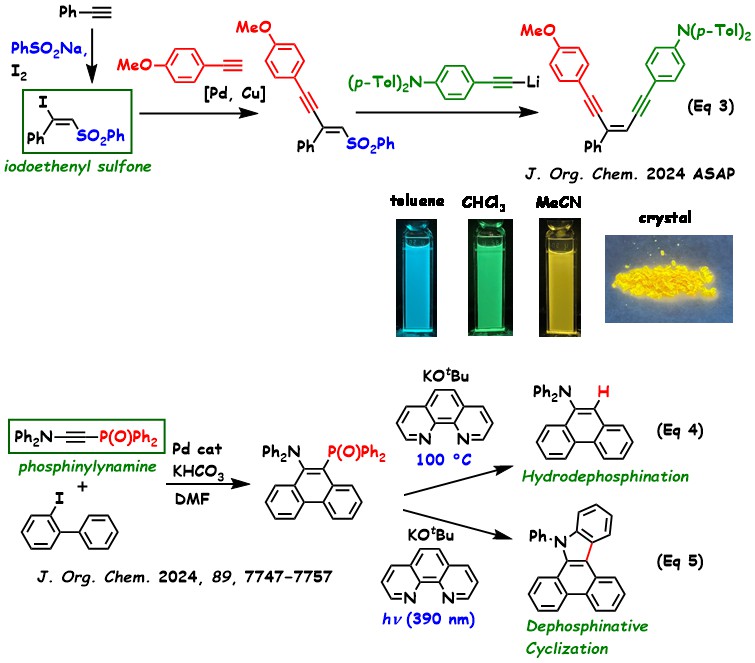
最近では、ヨードエテニルスルホンを鍵中間体に用いて、3種類のアセチレンを直接的に連結することで、エンジインの合成に成功している。アミノ置換したエンジインは、溶液中や固体状態で紫外線照射下において蛍光発光を示す。このとき、無極性な溶媒から高極性な溶媒に変更することで、発光色が青色から黄色へと変化することが確認された。
【有機リンを用いた反応】 ホスフィニルイナミンは、高活性なため取り扱いが困難なイナミン(アミノアセチレン)を、強力な電子求引基で安定化させた化学種である。 パラジウム触媒を用いたホスフィニルイナミンとヨードビフェニルとの環化付加反応から、9,10位をアミノ基とホスフィニル基で置換したフェナントレンが得られている。これを加熱下でカリウム
t-ブトキシドとフェナントロリンで処理すると、脱ホスフィニル化が進行し、アミノフェナントレンが生成された(式4)。一方、紫外光(390 nm)を照射しながらカリウム
t-ブトキシド/フェナントロリンで処理した場合には、脱ホスフィニル化と同時に環化反応が進行し、カルバゾール誘導体が得られている(式5)。
応用展開Application
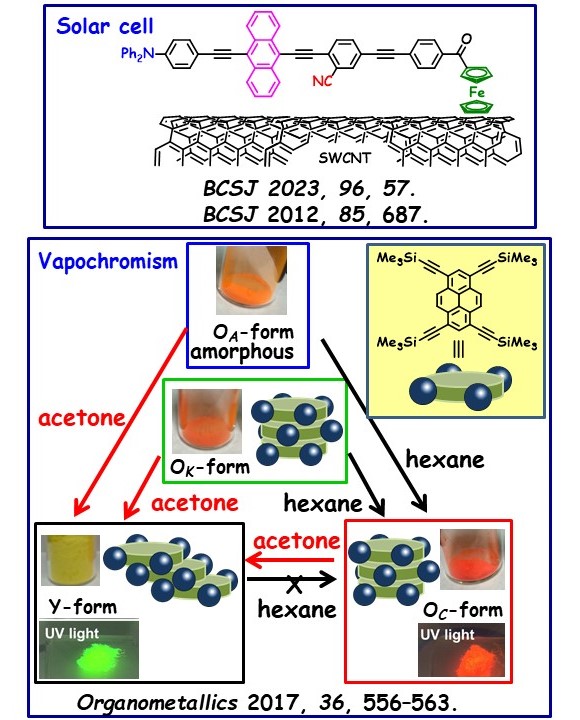
我々は独自の分子設計指針に基づき、π拡張化合物を合成し、これらを太陽電池(光電変換)の作製や結晶多形を示す蛍光発光化合物の創製に展開している。
【太陽電池(光電変換)】(図1)
アントラセンを含むフェニレンエチニレンに電子供与基および電子求引基を導入することで、可視光領域で十分な吸光度を持つ色素を合成した。この色素の末端にフェロセンを置換した結果、単層カーボンナノチューブ(SWCNTs)に強固に物理吸着することが明らかになった。この吸着にはアントラセンとフェロセンが重要な役割を果たしている。得られた有機色素/SWCNT複合体を水溶性アミノデンドリマーを用いて水中に懸濁し、可視光を照射したところ、期待通り光電変換が生起した。この光電変換により、ビオローゲンジカチオンが一電子還元され、水溶液が直ちに青色に呈色した。
【結晶多形を示す蛍光発光化合物】(図2)
ピレンの1,3,6,8位にシリルエチニル基を導入した結果、得られたテトラエテニルピレンは、嵩高いシリル基の立体障害により分子間のスリッページや回転が阻害され、結晶多形性(polymorphism)を示した。この分子は分子パッキングの違いによって4種類の多形を形成し、それぞれ異なる波長で蛍光発光を示した。さらに、これらの4つの多形は加熱、圧砕混和、有機溶媒蒸気への暴露といった物理的刺激によって相互に変換可能であることが確認された。
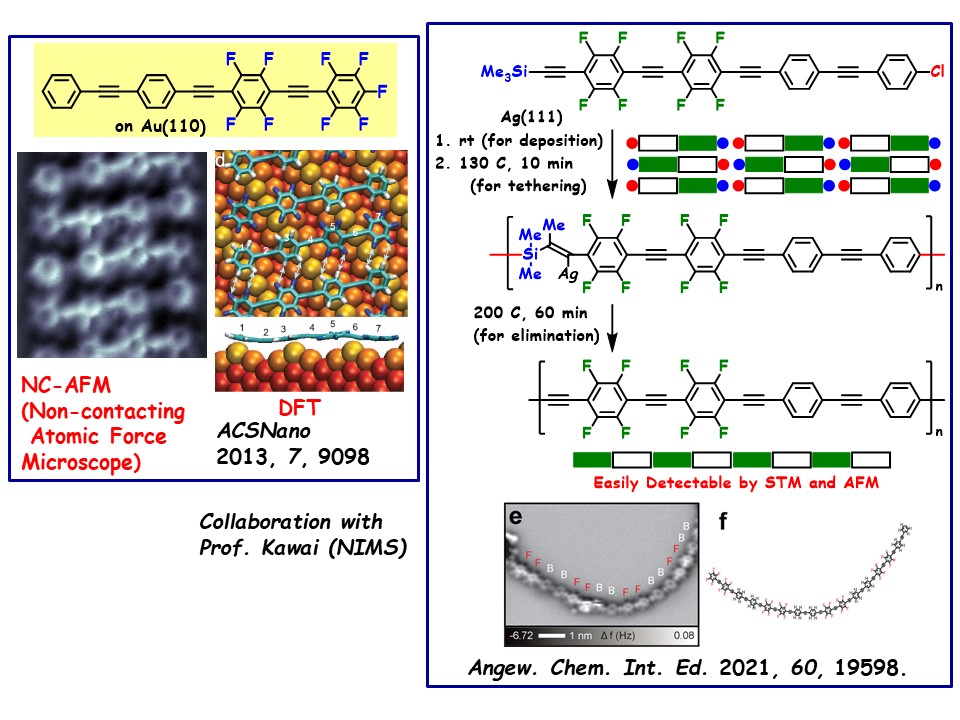
我々は表面科学の専門家との共同研究を進め、分子の自己集積化やオリゴマー化に関する成果を得ている。
【フッ素置換フェニレンエチニレンの自己集積化】(図3)
部分的にフッ素置換されたフェニレンエチニレンを、極低温・超高真空下で金(110)面上に蒸着したところ、分子の自己集積が観測された。この集積化は、水素結合による分子間相互作用に加え、フェニレンエチニレンのπ電子と求電子的な金原子との相互作用によって生じることが明らかとなった。
【フッ素置換フェニレンエチニレンのオリゴマー化】(図4)
部分的にフッ素置換されたフェニレンエチニレンの両端にクロロ基とシリルエチニル基を導入した。この化合物を超高真空下で銀(111)面上に蒸着すると、分子の自己集積体が観測された。その後、基板を130℃に加熱すると、シリル基上からアセチレン炭素への1,2-メチル転位を伴う分子間ケイ素―炭素結合生成反応が進行した。さらに200℃に加熱することで、トリメチルシリル基の脱離が進み、フェニレンエチニレンオリゴマーが生成された。
このオリゴマーは、フェニレンとフッ素置換フェニレンが2ユニットずつ交互に連結していることがAFM観測によって確認された。この規則的な構造は、自己集積したフェニレンエチニレンを出発点としてオリゴマー化を開始したことに起因することが実験的に示された。
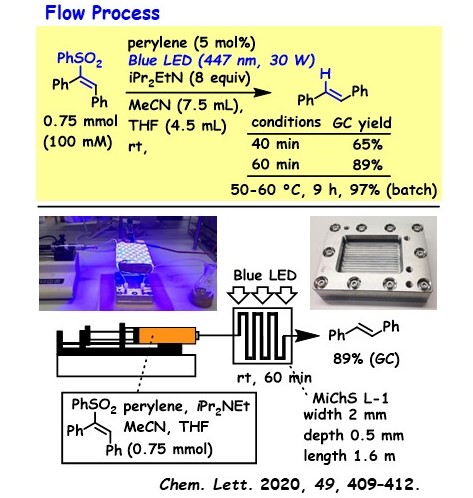
我々はフローマイクロ合成の専門家との共同研究を進め、反応効率の向上に関する成果を得ている。 マイクロリアクターを用いてエテニルスルホンの光レドックス反応を実施したところ、反応は1時間以内に完結し、対応するオレフィンが得られることが明らかとなった(図5)。一方、同じ反応をフラスコを用いたバッチ反応として行った場合、反応完結には9時間を要した。これらの結果から、マイクロ流路を用いた光反応では、光エネルギーがより効果的に化学変換に利用されていることが示された。 現在、我々は岡山県内の金属加工業者と共同で、チューブリアクターやマイクロリアクターの開発にも取り組んでいる。

